Carmat explicó en un comunicado que el marcado CE conseguido el pasado 22 de diciembre le abre la puerta a "una oportunidad de mercado muy importante", teniendo en cuenta que en cinco grandes países europeos (Francia, Alemania, Italia, España y Reino Unido) hay "al menos 2.000 pacientes" actualmente en espera de un trasplante.
La empresa, que utilizará la marca Aeson, prevé concentrarse este año en Alemania y en Francia, que representan el 55 % de los dispositivos de asistencia circulatoria mecánica en la Unión Europea (UE).
No obstante, tampoco descarta "aprovechar oportunidades comerciales" en otros países que reconozcan la certificación CE.
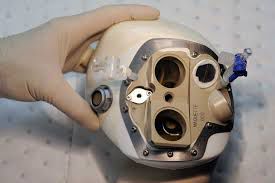
En paralelo a esta comercialización, continuará con su plan clínico que incluye un estudio en Francia con 52 pacientes, la finalización de otro ensayo, bautizado Pivot, en el que hay actualmente 15 pacientes, y el seguimiento clínico de los 95 primeros que se acojan al desarrollo comercial de este corazón artificial que cuesta unos 150.000 euros.
La compañía francesa planea fabricar en su planta de Vélizy, en las afueras de París, unas 300 unidades anuales de aquí a tres años.
En los ensayos clínicos realizados hasta ahora, solo uno de los trasplantados ha logrado sobrevivir más de dos años. Por eso se dirige especialmente a personas en estado terminal en espera de un órgano vivo. De hecho, podría servir para prolongar la espera de un corazón natural.
La primera experiencia de Carmat con un enfermo tuvo lugar en 2013.
Con información de EFE

Acerca de los comentarios
Hemos reformulado nuestra manera de mostrar comentarios, agregando tecnología de forma de que cada lector pueda decidir qué comentarios se le mostrarán en base a la valoración que tengan estos por parte de la comunidad. AMPLIAREsto es para poder mejorar el intercambio entre los usuarios y que sea un lugar que respete las normas de convivencia.
A su vez, habilitamos la casilla [email protected], para que los lectores puedan reportar comentarios que consideren fuera de lugar y que rompan las normas de convivencia.
Si querés leerlo hacé clic aquí[+]